С.А.Агеева, В.П.Минаев. Современные лазерные скальпели как основа внедрения высокоэффективных и стационарозамещающих технологий в оториноларингологии. Центральная п-ка МПС №2; НТО «ИРЭ-Полюс».
Untitled Document
Введение
За предшествующие три десятилетия были разработаны эффективные лазерные технологии хирургического лечения различных заболеваний, и лазерные скальпели стал привычными и эффективными инструментами для врачей крупных медицинских центров.
Привлекательность лазерных технологий объясняется рядом преимуществ перед альтенативными методами. Прежде всего, рассекая ткани, лазерный луч одновременно коагулирует кровь на стенках разреза. Благодаря этому сокращаются кровопотери, появилась возможность работы на кровенаполненных органах, например печени, реализуется давняя мечта хирургов – возможность работы на сухом операционном поле. Минимальным оказывается послеоперационный отек. При операциях, проводимых без общего наркоза, уменьшаются операционные и послеоперационные боли, снижается психологическая травма пациентов, особенно детей. Поскольку воздействие на биоткани осуществляется дистанционно лазерным лучом или раскаленным в точке контакта концом световода, происходит стерилизация гнойных ран, резко снижается вероятность послеоперационного заражения (в том числе ВИЧ и гепатитами).
Создание гибкого оптического волокна, способного практически без потерь передавать введенное в него лазерное излучение, не только повысило удобство работы с лазерным скальпелем, но и сделало его идеальным инструментом для малоинвазивных лапароскопических и эндоскопических операций. Были разработаны уникальные пункционные операции, при которых световод лазерного скальпеля подводится к очагу патологии через тонкую полую иглу.
На основе лазерных установок для хирургии разработан ряд прогрессивных методик силовой лазерной терапии (не путать с низкоинтенсивной лазерной терапией, в данной работе не рассматриваемой) позволяющих в некоторых случаях заменить хирургическое вмешательство. К ним относятся, например, фотодинамическая терапия и интерстициальная лазерная термотерапия злокачественных и доброкачественных опухолей, а также лазерная термопластика хрящей.
В настоящей работе описывается современная хирургическая лазерная аппаратура и возможности ее использования при хирургии и силовой терапии ЛОР заболеваний. Она написана на основе результатов, полученных авторами в ходе использования в Центральной поликлинике МПС №2 при лечении различных ЛОР-патологий. Актуальность полученных результатов определяется большой распространенностью ЛОР-заболеваний.
Следует отметить, что к настоящему времени написано и опубликовано достаточное количество монографий и методической литературы [1-5], посвященной использованию лазерных методов при лечении ЛОР-заболеваний и являющейся хорошей основой для их внедрения в массовое здравохранение. Задача настоящей публикации заключается в том, чтобы познакомить широкий круг практикующих оториноларингологов с современными лазерными аппаратами и методами их применения, показать, что их внедрение может позволить более эффективно использовать отпущенные на здравоохранение средства, как с точки зрения государства, так и с точки зрения пациентов.
Лазерная аппаратура
В течение длительного времени сложность лазерной медицинской техники, необходимость постоянного квалифицированного инженерного обслуживания, потребность использования специальных операционных, обусловленная громоздкостью оборудования и необходимости мощного питания, мешали широкому использованию лазерной техники для хирургии и силовой терапии в массовом здравоохранении, особенно его амбулаторном звене.
Эти недостатки были обусловлены низкой эффективностью лазеров и особенностью их конструкции, тем, что они состояли из отдельных оптических элементов, весьма точно расположенных (съюстированных) друг относительно друга. Малейшее нарушение взаимного расположения элементов в таких лазерах приводит к уменьшению мощности лазерного излучения или его исчезновению. В такой конструкции возникает еще одна проблема: пыль и влага, попадающие внутрь лазерного резонатора, поглощают лазерное излучение. Это в лучшем случае приводит снижению уровня выходной мощности, а в худшем к выходу из строя (прогоранию) элементов, образующих лазер.
Появление в последнем десятилетии ХХ века мощных полупроводниковых лазеров (лазерных диодов), быстрый прогресс в увеличении коэффициента полезного действия, надежности и реализуемых уровней выходной мощности при снижении себестоимости позволили в значительной степени устранить эти препятствия. Исчезла необходимость в мощном специальном питании и жидкостном охлаждении, уменьшились габариты и вес аппаратов.
Дополнительные возможности открылись при использовании принципов волоконной оптики внутри лазера. Появились аппараты, в которых лазерный модуль выполнен в виде интегрального волоконного устройства, т. е. не содержит нуждающихся в точной настройке и подверженных внешним воздействиям дискретных элементов.
Схема подобного аппарата представлена на рис. 1. Излучение лазерных диодов с волоконным выводом излучения 1 с помощью специальных сварных элементов 2 сводится в единое волокно 3, из которого через разъем 4 подается в рабочий световод 5. Разработанные технологии позволяют ввести в устройство участок активированного волокна 6 с волоконными аналогами зеркал 7, образующие волоконный лазер. При этом появляется возможность получения лазерного излучения с другими длинами волн. Фактически такое устройство представляет собой моток оптического волокна с приваренными к нему лазерными диодами и, благодаря свойствам волокна удерживать свет, не нуждается в юстировке и не боится внешних механических воздействий вплоть до величины, приводящей к разрушению волокна. Понятно, что внутрь волокна нет доступа пыли и влаге.
Итак, в настоящее время созданы условия для вытеснения из медицинских аппаратов традиционных лазеров лазерными диодами и лазерами с диодной накачкой. Это обусловлено следующими их преимуществами:
-малые габариты, вес и энергопотребление (достаточно бытовой электросети);
-отсутствие потребности в жидкостном охлаждении;
-высокая надежность и большой ресурс работы;
-простота в обращении, отсутствие необходимости в частом проведении регламентных работ и квалифицированном обслуживании;
-высокая стабильностью параметров, простота управления характеристиками излучения (мощность, модуляция и, в определенной степени, длина волны излучения);
-низкая чувствительность к механическим и климатическим воздействиям.
Высокая надежность, простота управления, малые вес, габариты и энергопотребление позволяют использовать современные лазерные скальпели на основе мощных полупроводниковых и волоконных лазеров в лечебных учреждениях массового здравоохранения, не имеющих инженерно-технических служб, при этом снижаются расходы на их эксплуатацию. Низкая чувствительность к внешним воздействиям в сочетании с малым энергопотреблением позволяет использовать подобные аппараты во внеклинических условиях. Дополнительным положительным фактором является появление отечественной техники, более дешевой (в несколько раз), чем аналогичная импортная и не уступающей импортной по характеристикам.
В таблице 1 представлены данные отечественных (разрешенных МЗ РФ к применению) аппаратов такого типа. Из перечисленных аппаратов рядом преимуществ обладают скальпели «Лазон-10П» и «ЛС-ИРЭ-Полюс». Это, прежде всего большой ресурс работы силовых полупроводниковых лазеров. В этих аппаратах используется зеленый лазер-целеуказатель, цвет которого хорошо виден на фоне красных тканей и не поглощается очками, защищающими глаза от рабочего излучения. Расположение разъема для присоединения волоконных инструментов в нише на верхней крышке блока снижает вероятность повреждения световода, а наличие в нише места для укладки световода волоконного инструмента позволяет избежать лишних отсоединений при хранении и переноске. И, наконец, именно эти аппараты выполнены на основе принципа интегральных оптических устройств. На рис.2 представлен внешний вид лазерного скальпеля «ЛС-ИРЭ-Полюс.
В настоящее время завершаются клинические испытания новых лазерных скальпелей семейства «ЛС-ИРЭ-Полюс». Это аппараты с длинами волн рабочего излучения 1,06 мкм, 1,9 мкм и обеспечивающий подачу в одно волокно двух независимо регулируемых рабочих излучений с длинами волн 0,97 мкм и 1,56 мкм. Последний позволяет врачу непосредственно во время операции в широких пределах менять характер воздействия лазерного излучения на биоткани.
Особенности воздействия на биоткани лазерного излучения с различными длинами волн.
Длина волны лазерного излучения оказывается основным фактором, определяющим глубину воздействия излучения на биоткани, а, значит, и объем ткани, в котором происходит тепловыделение. На рис. 3 представлены зависимости относительных коэффициентов поглощения лазерного излучения от длины волны в воде, оксигемоглобине и меланине. Кроме этого на рисунке отмечены длины волн лазерных аппаратов выполненных на основе лазерных диодов или лазеров с диодной накачкой, используемых или имеющих хорошие перспективы применения в хирургии.
Из рисунка видно, насколько сильно зависит поглощение в этих средах от длины волны излучения. Например, излучение с длинами волн 0,81 и 1,04…1,06 мкм проникает в биоткани глубже, чем излучение с длиной волны 0,97 мкм, которая приходится на локальные максимумы поглощения в воде и оксигемоглобине, являющихся основными компонентами мягких тканей человека. Таким образом, излучение с длинами волн 0,81 и 1,04…1,06мкм может быть эффективно использовано для объемного (на глубину до 1 см ) прогрева биотканей вплоть до температуры их коагуляции, что необходимо, например, для термотерапии опухолей (см.напр. [6]). В то же время, использование этих длин волн в хирургических целях требует повышения мощности излучения и может приводить к нежелательному тепловому повреждению подлежащих органов (следует отметить, что существуют приемы, позволяющие уменьшить глубину воздействия).
Излучение с длиной волны 0,97 мкм поглощается в поверхностных слоях мягких биотканей, и зона нагрева составляет величину порядка 1 мм . При этом снижается риск повреждения лазерным излучением подлежащих органов, а режущий эффект близок к действию в 2-3 раза более мощного излучения с длинами волн 0,81 мкм и 1,04 мкм и мало зависит от вида биоткани. Кроме того, указанная глубина теплового поражения обеспечивает хороший гемостаз [7].
Из вышеизложенного следует, что большой возможный разброс рабочих длин волн (0,98-1,04) у аппарата ЛМА, (см. табл.1) затрудняет прогнозирование характера воздействия на биоткани и может приводить к результатам, отличным от ожидаемых хирургом.
Излучение с длиной волны 1,56 мкм сильнее поглощается в воде, а значит и в биотканях, а в оксигемоглобине поглощается слабее. Такое соотношение привлекательно для прогрева хряща носовой перегородки при исправлении ее формы методом лазерной термопластики [8], поскольку позволяет уменьшить тепловое повреждение слизистой, через которую это излучение проходит.
Наконец, излучение 1,9 мкм поглощается в воде практически так же сильно, как излучение углекислотных лазеров (10,6 мкм), но, в отличие от последнего, может передаваться по кварцевому оптическому волокну. При этом из-за малой глубины проникновения режущий эффект достигается при малых уровнях выходной мощности. Вместе с тем, из-за уменьшения глубины прогрева уменьшаются гемостатические свойства излучения.
Еще раз отметим, что приведенные на рис. 2 зависимости поглощения от длины волны лазерного излучения могут быть использованы только для качественного прогноза результата силового лазерного воздействия на биологические объекты. Процесс распространения лазерного излучения через неоднородные материалы, какими являются биоткани, не описывается одним коэффициентом поглощения. Наряду с поглощением глубина проникновения излучения зависит от его рассеяния в биоткани. Сильное влияние на процесс распространения лазерного излучения оказывает изменение свойств биоткани под его воздействием. Такое изменение может быть обусловлено очевидными причинами, как, например, обугливание биоткани, увеличивающее величину поглощения, либо более тонкими процессами, как, например, изменение кровотока в процессе нагрева биоткани [9].
Следует различать два метода воздействия лазерного скальпеля на биоткани. При бесконтактном использовании воздействие на биоткань осуществляется только лазерным излучением. При этом часть излучения отражается и рассеивается вне объекта воздействия. Уменьшить эту часть излучения можно использовав предварительное подкрашивание зоны воздействия раствором марганцовокислого калия или бриллиантового зеленого. Дополнительным средством регулирования глубины воздействия является угол наклона, под которым излучение направляется на объект воздействия.
Второй метод - использование контактных методик, при которых зачищенный от защитных оболочек дистальный (выходной) конец кварцевого световода или специальный наконечник (из сапфира или кварца) вводится в соприкосновение с тканью. В месте соприкосновения с тканью на материал светопровода налипают частицы сгоревших тканей, в которых поглощается лазерное излучение, при этом происходит сильный разогрев материала, и действие лазерного излучения дополняется термическим воздействием раскаленного конца волокна или наконечника. Благодаря этому возрастает эффективность воздействия на ткань и снижается уровень лазерной мощности, рассеиваемой в пространство. Кроме этого, при том же достигаемом эффекте становится меньше, чем в бесконтактном методе, глубина термического поражения. Немаловажную роль в характере воздействия лазерного излучения на биоткани имеют его временные характеристики. Дело в том, что температура и область нагрева определяются результатом одновременного действия нагрева ткани лазерным излучением и переноса тепла от тканей нагреваемых при поглощении лазерного излучения в прилежащие области. Различие во времени быстрого разогрева за счет превращения энергии лазерного излучения в энергию колебаний атомов и молекул и сравнительно медленного процесса теплопереноса дает возможность дополнительной регулировки характера воздействия на ткань.
Так, при длительном воздействии низкими уровнями мощности происходит эффективная теплопередача от места воздействия на прилежащие к зоне воздействия области, ведущая к их разогреву. Такое действие желательно при медицинских методиках, основывающихся на прогреве биотканей, например, интерстициальной лазерной терапии, основанной на разогреве злокачественных опухолей изнутри до температуры, ведущей к гибели раковых клеток. Наоборот, воздействие коротким мощным импульсом лазерного перфоратора ведет к мгновенной вапоризации ткани с образованием канала для забора крови. При этом нагрев стенок канала столь мал, что не происходит закупоривание сосудов из-за коагуляции. При хирургических воздействиях, как правило, требуется оптимальное нагревание прилежащих к месту разреза областей, обеспечивающее, с одной стороны коагуляцию, достаточную для гарантированного предотвращения кровотечений, с другой стороны минимальное термическое воздействие на прилежащие к зоне воздействия органы. Помимо подбора длины волны излучения это достигается выбором непрерывного или импульсно-периодического режима излучения. При импульсно-периодическом режиме импульсы лазерного излучения с мощностью, достаточной для осуществления, например, резания, сменяются паузами, во время которых прилежащие к зоне реза ткани успевают остыть и, тем самым, предотвращается их тепловое повреждение.
Вследствие вышеизложенного, точные значения глубины прогрева различных биологических тканей могут быть получены только из эксперимента. Поэтому врач, прогнозируя эффект лазерного воздействия, должен опираться на результаты опыта работы по конкретным тканям, и в ходе операции быть готовым при необходимости корректировать уровень мощности лазерного излучения по результатам его воздействия.
Возможности и особенности использования современных лазерных скальпелей в ЛОР практике.
Лазерные методы воздействия хорошо сочетаются с современной эндоскопической техникой, в частности с жесткими эндоскопами. Преимущества такого сочетания хорошо реализуются при лечении ЛОР заболеваний.
Прежде всего, следует отметить, что врач получает возможность очень точных воздействий на оперируемый орган. Хороший гемостаз позволяет сохранять сухим операционное поле, а эндоскопическая (тем более, видеоэндоскопическая) техника позволяют врачу осуществлять точные манипуляции. Возможность осуществления точных, строго дозированных воздействий позволяет разработать органосберегающие операции, например, вместо удаления аденоидов ограничится частичным удалением соединительной ткани, сформировать в аденоидах каналы для оттока жидкости, сохранить этот орган, играющий важную роль в обеспечении иммунитета.
Надежная коагуляция в оперируемых органах является хорошей предпосылкой к переходу на амбулаторные методы лечения.
При традиционных, а также крио- и электрокоагуляционных вмешательствах в ЛОР органы велика вероятность большого послеоперационного отека, который в некоторых случаях вынуждает к осуществлению реанимационных мероприятий после завершения собственно операции. Использование лазерных методов при правильном их применении позволяют резко снизить величину послеоперационного отека, избежать нежелательных последствий и сократить время пребывания больного в операционной.
Лазерные методы в сочетании с современными методами местной анестезии позволяют осуществлять операции практически безболезненно. Уменьшаются и послеоперационные боли. Это не только снижает мучения пациента, но и, наряду с уменьшением психического воздействия последствий кровотечений, делает более спокойным поведение пациентов (включая детей) во время операции, что так же облегчает врачу проведение операции.
Многолетний опыт клинического применения показал, что раны от лазерного излучения быстро заживают, мала вероятность осложнений.
Свойства лазерного излучения позволяют создать новые высокоэффективные методики. Примером может служить выше упоминавшаяся процедура коррекции такой патологии, как искривление хрящевой части носовой перегородки. При этой процедуре хрящ перегородки нагревается лазерным излучением до температуры 60…70 о С. При этой температуре хрящевая ткань становится пластичной и перегородке может быть придана необходимая форма. При остывании с фиксацией новой формы упругость восстанавливается и в дальнейшем сохраняется. Следует отметить, что благодаря низкой температуре нагрева не повреждаются центры роста в хряще. Поэтому такая процедура может производиться в детском возрасте
Описанные преимущества позволяют пересмотреть подход к операционному лечению ЛОР заболеваний. Если при традиционных методах врач за один раз ставил целью операции устранение одного очага патологии, то с использованием современных лазерных эндоскопических методов можно перейти к концепции полной санации носоглотки в процессе одного хирургического вмешательства. И выполнено такое вмешательство может быть без госпитализации больного.
В условиях дневного стационара Центральной поликлиники №2 МПС за три года было проведено лечение 233 больных в возрасте от 3,5 до 64 лет. У каждого больного были диагностированы от 2 до 6 сочетающихся ЛОР патологий, в числе которых:
-гипертрофия носовых раковин;
-искривление носовой перегородки;
-доброкачественные образования полости носа;
-хронический риносинусит;
-полипозный риносинусит;
-аденоидные вегетации;
-хронический аденоидит;
-хронический тонзиллит;
-вазомоторный ринит;
-вазомоторный сальпингит (евстахеит);
-экссудативный отит;
-гранулезный фарингит;
-доброкачественные образования глотки;
-доброкачественные образования гортани;
-гиперпластический ларингит;
-ронхопатия и другие заболевания.
Количество больных и проведенных им операций представлено в таблице 2. У всех больных получены положительные результаты. К сожалению, наблюдение отдаленных результатов затруднено, поскольку, избавившись от недуга, пациенты крайне неохотно приходят на обследование.
Приведем несколько конкретных примеров.
Евгений Ж. 10 лет.
Наблюдался по поводу астмы, диэнцефального синдрома, постоянно болел на фоне обострений астмы, имел избыточный вес.
Диагностированы аденоиды Ш ст., дусторонний гайморит, хронический тонзиллит, двусторонний тубоотит.
28.11.01г. проведены:
• селективно-базальная аденотомия;
• селективная денервация полости носа.
Перестал болеть, прекратились приступы астмы, диэнцефальный синдром регрессировал, вес нормализовался.
Павел З. , 7 лет.
В 3 года удалены аденоиды, в 4 года перенес инфекционный мононуклеоз, в течение 3 лет практически непрерывно болел.
Диагностированы рецидив аденоидных вегетаций Ш ст., хронический тонзиллит вне обострения, искривление носовой перегородки, гранулезный фарингит, хронический экссудативный средний отит с потерей слуха до 40 дб., синдром патологической адаптации.
25.06.02г. проведены:
- коррекция формы хрящевого отдела носовой перегородки методом лазерной термопластики;
• конхопексия средних носовых раковин;
• селективно-базальная аденотомия;
• лазерная вапоризация трубных миндалин.
По наблюдению через 7 месяцев перестал болеть, нормализовались слух и носовое дыхание.
Михаил Н. 32 года.
Травматическая деформация носа и носовой перегородки, круглогодичный насморк, частые ОРВИ, сильно затруднено носовое дыхание.
11.02.03г. проведены:
• риносептопластика с коррекцией хрящевого отдела носовой перегородки и клапана носа слева методом лазерной термопластики;
• селективная денервация полости носа;
• лазерная деструкция задних концов нижних носовых раковин;
• конхопексия.
Исправлена форма носа, восстановлено носовое дыхание.
Большинство манипуляций при лечении осуществлялось при эндоскопическом наблюдении вначале с помощью лазерного скальпеля «Лазон-10П», а затем «ЛС-0,97-ИРЭ-Полюс» с длиной волны рабочего излучения 0,97 мкм, и максимальной выходной мощностью 20 Вт. При проведении части процедур лазерной термопластики хрящей дополнительно использовался лазерный скальпель «ЛС-1,56-ИРЭ-Полюс» с длиной волны 1,56 мкм, что позволяло оптимизировать операцию.
После операции больной, как правило, до конца рабочего дня оставался в дневном стационаре, после чего шел домой. На следующий день больному проводился контрольный осмотр, в ходе которого проводилась обработка послеоперационных ран, и назначался срок следующего осмотра.
Необходимо отметить, что при хирургическом лечении пациентов без госпитализации особенное внимание должно быть уделено инструктажу пациентов относительно послеоперационного лечения, включая порядок действий в случае экстренных обстоятельств, например, внезапно начавшемся кровотечении. Опыт показывает, что результаты лечения бывают настолько разительны, что пациенты могут переоценить свое состояние, неосторожно обращаться со своим здоровьем, что особенно свойственно подросткам и молодым людям.
Выводы
Опыт использования лазерных скальпелей в медицинских учреждениях показал реальную возможность улучшения качества лечения и уменьшения страдания пациента при одновременном сокращении послеоперационного периода и сроков лечения . Можно расширить области хирургических вмешательств, выполняемых амбулаторно или в стационаре одного дня, сократить время пребывания в условиях больничного дискомфорта. В частности, это относится к лечению ЛОР заболеваний.
Использование современных лазерно-эндоскопических методов лечения позволяет получить экономический эффект за счет сокращения числа необходимых койко-мест и уменьшения срока возвращения пациента к трудовой деятельности .
В России существуют идеальные условия для широкого внедрения аппаратов в массовое здравоохранение:
- наличие центров, ведущих разработку новых медицинских лазерных технологий, имеющих большой опыт использования подобной техники в лечебной практике и аккредитованных МЗ РФ для подготовки врачей;
- невысокая стоимость отечественного оборудования и его эксплуатации при сочетании с высокой надежностью и возможностями, не уступающим лучшим импортным образцам;
• близость производителей позволяет уменьшить стоимость послегарантийного обслуживания (которое, как показывает практика, оказывается минимальным).
Литература
[1] Чирешкин Д.Г., Дунаевская А.М., Тимен Г.Э. «Лазерная эндоскопическая хирургия верхних дыхательных путей» – М.: Медицина, 1990,192с.
[2] Плужников М.С., Лопотко А.И., Гагауз А.М. «Лазеры в ринофарингологии» – Кишинев: «ШТИИНЦА», 1991, 157с.
[3] Зенгер В.Г., Наседкин А.Н. «Лазеры в оториноларингологии» - Тверь: «ТОО Фирма «Техника», 2000г. 140с.
[4] Плужников М.С., Лопотко А.И., Рябова М.А. «Лазерная медицина в оториноларингологии» – Минск: «ПП-АНАЛМ»-«БДП», 2000, 224с.
[5] Гаращенко Т.И., Богомильский М.Р., Минаев В.П. «Лечение ЛОР-заболеваний с использованием лазерных скальпелей» Пособие для врачей- Тверь: ООО «Губернская медицина» 2001.52с.
[6] Chapmen R. Lasers in Surgery and Medicine, 22 , 171(1998)
[7] С ecchetti W. et.al. SPIE of Bios Europe'96, The Biomedical Optics Week (Vien, 1996)
[8] Баграташвили В.Н. с соавт. В сб. «Использование лазеров для диагностики и лечения заболеваний» (М., Лазерная ассоциация 3, 2001 с.114).
[9] Лубашевский И.А. с соавт. В сб. « Использование лазеров для диагностики и лечения заболеваний » -М. «Лазерная ассоциация», 1996г., с.14-17.
|
1 |
2 |
3 |
7 |
4 |
5 |
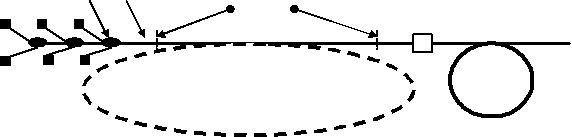 |
Рис.1
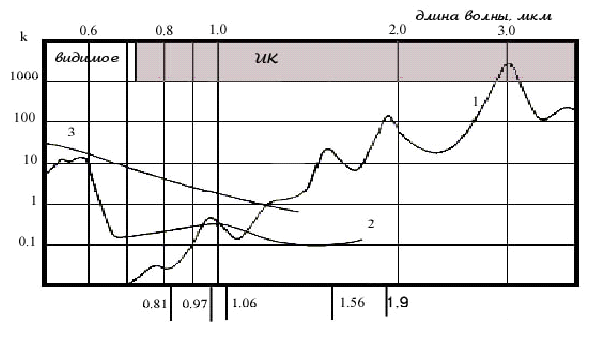
Рис.3 Зависимость поглощения излучения от длины волны в воде (1), оксигемоглобине (2) и меланине (3).
0,81 и 0,97 мкм – лазерные диоды;
1,06 – лазерные диоды и волоконные лазеры на Yb -активированном волокне;
1,56 - волоконные лазеры на Eb -активированном волокне;
1,9 - волоконные лазеры на Tm -активированном волокне.
Таблица 1
Отечественные аппараты для хирургии и силовой терапии на основе полупроводниковых и волоконных лазеров (серийный выпуск).
|
АЛод-01
"АЛКОМ" |
Лазон-10П |
ЛС-0,97-ИРЭ-
Полюс |
ЛС-1,56-ИРЭ-
Полюс |
АТКУС-15 |
Кристалл |
ЛМА |
Длина волны, нм |
810 или 980 |
970 |
970 |
970 |
810 или 980 |
808 |
980…1040 |
Мощн. изл., Вт |
3(6;9;12) |
10 |
10 (20;30) |
5 (10) |
15 |
7 |
40(10;20;80) |
Режим. |
Имп., непр. |
Непр. |
Имп., непр. |
Имп., непр. |
Имп., непр. |
Имп., непр. |
Имп., непр. |
Пилот-лазер |
Красный |
зеленый |
зеленый |
зеленый |
красный |
красный |
красный |
Масса, кг |
7,5(?) |
6,5 |
6,5(9) |
6,5(9) |
15 |
5 |
28 |
Габариты, см |
|
12х26х33 |
12х26х33 |
12х26х33 |
37х50х17 |
13х26х30 |
27х26х90 |
Потр. мощн. ВА |
От 50 до 600 |
70 |
70 (100) |
70 (100) |
|
<100 |
200 (до 900) |
Ресурс, час. |
|
20000 |
20000 |
20000 |
10000 |
|
|
Øвол., мм |
0,4 |
0,4…0,6 |
0,3…0,6(0,6) |
0,3…0,6(0,6) |
0,6 |
0,6 |
0,8(0,4;0,6;1) |
Цена, руб.экв.*, $ |
3750…15000 |
6500 |
5900(8500,
12700) |
10500(18500) |
12500 |
8000 |
16800 |
Изготовитель |
НПО "АЛКОМ-медика",
С.-Петерб. |
ФНПЦ "Прибор", Москва |
НТО"ИРЭ-Полюс"
Фрязино |
НТО"ИРЭ-Полюс"
Фрязино |
"Полупро-
воднико-вые
приборы"
С.-Петерб. |
ИППВО,
Москва |
КБП, Тула |
Таблица 2
Категория больных |
2000г. |
2001г. |
2002г. |
Общее количество |
|
больных |
операций |
больных |
операций |
больных |
операций |
больных |
операций |
Мужчины |
11 |
26 |
24 |
88 |
29 |
89 |
64 |
203 |
|
Женщины |
10 |
19 |
19 |
53 |
21 |
65 |
50 |
137 |
Дети |
4 |
7 |
37 |
95 |
49 |
116 |
90 |
218 |
Подростки |
5 |
18 |
8 |
21 |
16 |
56 |
29 |
95 |
Всего |
30 |
70 |
88 |
257 |
115 |
326 |
223 |
653 |
|






