В конце 60-х г. прошлого века у врачей появился новый инструмент, обладающий уникальными свойствами – луч лазера. Прежде всего, свет, генерируемый лазером, представляет собой практически параллельный луч, который может быть сфокусирован в пятно малого диаметра на объекте воздействия. При его поглощении в биотканях выделяется тепловая энергия, которая в зависимости от мощности может локально нагревать, коагулировать биоткани, резать и испарять их.
Разработаны (при этом весьма весом вклад советских и российских врачей) эффективные лазерные хирургические технологии лечения различных заболеваний, и лазерный скальпель стал привычным инструментом для врачей крупных медицинских центров. Уникальные свойства лазерного излучения позволили раз работать новые высокоэффективные методы лечения, основанные на таком воздействии лазерного излучения на биоткани, которое с одной стороны приводит к изменению их физического состояния, с другой стороны, не связано с воздействием в виде сечения или удаления биоткани, характерным для хирургии. Примером могут служить фотодинамическая терапия (ФДТ), лазерная интерстициальная термотерапия (ЛИТТ) опухолей и лазерная термопластика хрящевой ткани. Представляется объединить их термином «силовая лазерная терапия» в отличие от низкоинтенсивной лазерной терапии, использующие лазерное излучение с биостимулирующими уровнями мощности.
До середины 90-х г. прошлого столетия сложность лазерной медицинской техники, необходимость постоянного квалифицированного инженерного обслуживания, потребность в использовании специальных операционных, обусловленная громоздкостью оборудования и необходимостью мощного питания, мешали широкому использованию лазерной техники для хирургии в массовом здравоохранении. Ситуация изменилась в начале 90-х в связи с быстрым прогрессом в увеличении надежности и уровня выходной мощности полу проводниковых лазеров (лазерных диодов) при снижении их себестоимости. Немного позднее появились лазеры на активированном волокне, способные генерировать излучение мощностью в единицы, а затем десятки и сотни Ватт.
Все это позволило создавать на основе полупроводниковых и волоконных лазеров медицинские аппараты для хирургии и силовой терапии с прекрасными эксплуатационными характеристиками: малыми габаритами, весом (около 10 кг ) и энергопотреблением (порядка 100 Вт). Поскольку диодные лазеры можно просто модулировать по питанию, с их помощью легко реализуются различные временные (непрерывный, импульсный и импульсно-периодический) режимы работы.
Изменение ситуации качественное. Раньше лазерная операционная организовывалась вокруг лазерной установки с ее мощным питанием и большими габаритами, дороговизна оборудования практически исключала возможность оснащения разными по характеру воздействия лазерами, аппараты требовали постоянного инженерного обслуживания.
C появлением современных портативных аппаратов стало возможным, например, разместить в одной эндоскопической стойке несколько недорогих аппаратов, по-разному воз действующих на биоткани. На рис. 1 представлена фотография отечественной эндоскопической стойки «СОВА» в варианте комплектации с лазерным скальпелем. Немаловажно, что благодаря высокой надежности и простоте управления такие аппараты не требуют инженерного обеспечения при работе. Наконец, аппараты на основе полупроводниковых и волоконных лазеров оказываются дешевле аналогов на основе твердотельных и газовых лазеров. К этому добавляется более низкая стоимость эксплуатации, обусловленная отсутствием периодических профилактических работ.
Но и этим дело не ограничивается: расширился выбор длин волн лазерного излучения. Поскольку длина волны лазерного излучения определяет глубину его проникновения в различные биоткани и тем самым решающим образом влияет на характер и результаты воздействия, врачи получили возможность большого выбора характера воздействия на биоткани. К сожалению, недостаток информации о современной лазерной аппаратуре и созданных на ее основе технологиях мешает внедрению в массовое здравоохранение. Попыткой восполнить этот пробел, и является настоящая публикация.
2. Выбор длины волны рабочего излучения для различных применений.
Рассмотрим, какие длины волн наиболее широко используются в настоящее время в медицинской практике.
В течение долгого времени для хирургических применений использовались в основном лазеры на угле кислом газе (длина волны 10,6 мкм ) и алюмо-иттриевом гранате, активированном неодимом, (АИГ:Nd) с длиной волны 1,06мкм (такая же длина волны излучения может быть реализована с помощью полупроводниковых и волоконных лазеров).
Рис.2. Зависимость поглощения излучения в воде и цельной крови в диапазоне 0,7… 4мкм.
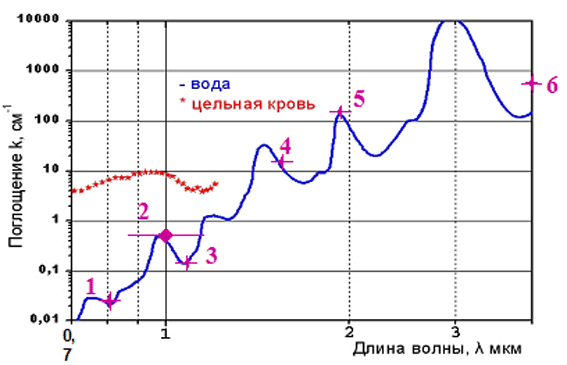
1 — полупроводниковые лазеры с длиной волны 0,81 мкм;
2 — полупроводниковые лазеры с длиной волны 0,94-0,98 мкм;
3 — полупроводниковые лазеры и лазеры на Yb - активированном волокне с длиной волны 1,04-1,08 мкм;
4 — лазеры на Yb – активированном волокне с длиной волны 1,56 мкм;
5 — лазеры на Tm – активированном волокне с длиной волны 1,9-2.1 мкм;
6 — уровень поглощения для излучения СО - лазеров с длиной волны 10,6 мкм.
На рис. 2 представлена зависимость поглощения лазерного излучения в воде и цельной крови (основных компонентах биотканей) в зависимости от его длины волны. Излучение 10,6 мкм сильно поглощается в биотканях, энергия выделяется в тонком слое биоткани, при этом достигается хороший режущий эффект, но глубина поглощения недостаточна для хорошей коагуляции. Кроме того, для такого излучения не созданы эффективные волоконные световоды, а зеркально-линзовые устройства транспортировки излучения обеспечивают достаточные возможности для врача только при открытых операциях. При работе в полостях тела и эндоскопиических операциях подобные системы доставки, если и могут быть использованы, усложняют работу хирурга.
Существенно удобнее хирургу работать с тонкими и гибкими волоконными световодами, которые через инструментальный канал эндоскопа или с помощью специальных инструментов могут подводиться к объектам воздействия, лежащим вне прямой видимости. В частности, доступные и надежные в эксплуатации световоды с сердцевиной из плавленого кварца хорошо передают лазерное излучение в диапазоне 0,4…2 мкм.
Рис. 3. Зависимость поглощения излучения в воде и цельной крови в диапазоне 0,7… 1,1 мкм
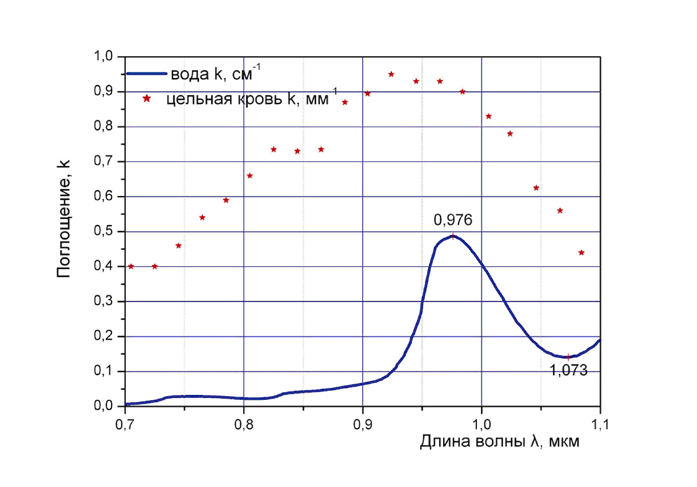
На рис. 3 представлены зависимости поглощения в воде и цельной крови в диапазоне 0,6…1,1 мкм, в который попадают длины волн излучения наиболее распространенных полупроводниковых лазерных скальпелей. Указанные зависимости могут быть качественно использованы при оценке глубины проникновения излучения в реальные биоткани. Следует отметить, что помимо поглощения на глубину проникновения излучения сильное влияние оказывает коэффициент рассеяния, величина которого в цельной крови превышает коэффициент поглощения и в указанном диапазоне составляет около 0,65 мм –1 . Благодаря рассеянию излучение в биоткани распространяется не только вдоль первоначального направления, но и в стороны. Кроме того, следует учитывать, что в процессе лазерного воздействия меняется физическое состояние биоткани и характер поглощения. Так, при нагреве до температуры выше примерно 150 ° С выгорает водород и происходит обугливания биоткани, при котором резко возрастает поглощение.
Излучение с длиной волны 1,06 мкм и близкое по характеру поглощения излучение с длиной волны 0,81 мкм , может передаваться по кварцевым световодам практически без потерь, оно проникает глубоко в биоткани, что хорошо для осуществления объемного прогрева и коагуляции. Вместе с тем, эти длины волн не являются оптимальными для достижения режущего эффекта: при работе на этих длинах волн, из-за распределения поглощаемой мощности в толще биоткани приходится увеличивать мощность излучения, при этом растет риск поражения при операции подлежащих органов.
Впрочем, учитывая невозможность для большинства лечебных учреждений иметь набор лазерных аппаратов, такое использование глубоко проникающего излучения (0,81 и 1,06 мкм) может быть оправдано. Дело в том, что глубина воздействия может быть уменьшена при использовании контактных методов, основанных на контактном воздействии на биоткани концом кварцевого световода. В этом случае в месте контакта образуются сильно поглощающие (обугленные) частицы, поглощаемое ими лазерное излучение нагревает дистальный конец кварцевого световода, который осуществляет дополнительное к световому тепловое воздействие на биоткани. Вместе с тем, врач в этом случае всегда должен помнить о потенциальной опасности нежелательного (а порой и опасного) воздействия на подлежащие органы. Приходящееся на локальные максимумы поглощения воды и цельной крови (рис.3) излучение лазерных диодов с длиной волны 0,97 мкм проникает в биоткани на глубину 1-2мм, благодаря чему хорошо сочетает режущие и кровоостанавливающие свойства и оказывается наиболее оптимальным при большинстве хирургических вмешательств
Следует отметить, что в литературе, в том числе методической [1,2] зачастую не делается различие в характере воздействия на биоткани излучений с длинами волн 0,81 и 1,06 с одной стороны и 0,97 с другой, что исходя из приведенных выше экспериментальных фактов, автор считает неправильным.
Излучение с длиной волны около 1,56 мкм (лазер на Er(эрбий) - активированном волокне или полупроводниковые лазеры) поглощается в воде на порядок сильнее, чем излучение с длиной волны 0,97 мкм, при примерно одинаковом поглощении в крови, что оказывается важным для ряда применений.
Лазеры на Tm (туллий) – активированном волокне могут генерировать излучение в диапазоне 1,9-2,1 мкм. Воздействие такого излучения на биоткани по характеру близко к воздействию излучения с длиной волны 10,6мкм , однако, в отличие от последнего, это излучение может передаваться по гибкому кварцевому волокну.
Излучение красного диапазона (0,63…0,67 мкм) широко используется в фотодинамической терапии (ФДТ) . Используя полупроводниковую накачку лазеров на АИГ:Nd и преобразуя излучение с длиной волны 1,06 мкм методами нелинейной оптики во вторую гармонику, можно получить излучение зеленого диапазона (0,53 мкм). Такое излучение находит широкое применение в офтальмологии и дерматологии, является наиболее эффективным, когда необходимо воздействовать на кровь. Следует отметить, что зеленое излучение представляет определенные неудобство для работы врача, поскольку приходится на максимум чувствительности глаз, и довольно трудно совместить хорошее восприятие операционного поля с надежной защитой глаз.
И, наконец, используя четвертую гармонику, можно получить ультра фиолетовое излучение с длиной волны 0,26 мкм . Последнее оказывается весьма эффективным средством для лечения все более распространяющихся форм туберкулеза, стойких к медикаментозному лечению.
Вышеупомянутые длины волн не исчерпывают возможности современных лазерных аппаратов. Так разрешенное МЗРФ для клинических применений семейство аппаратов «ЛАХТА-МИЛОН» позволяет реализовать 15(!) длин волн рабочего излучения в диапазоне 0,63- 1,75 мкм . Часть из этих длин волн еще не освоена врачами.
Повторюсь, что все эти длины волн излучения реализуются с помощью портативных, надежных лазерных аппаратов. Различие характера воздействия лазерного излучения на биоткани в зависимости от длины волны излучения, привело к созданию аппаратов, обеспечивающих генерацию лазерного излучения с двумя рабочими длинами волн. Эти аппараты позволяют врачу менять характер воздействия в ходе операции (процедуры) или использовать сочетанное воздействие излучений с разными длинами волн.
Примером таких аппаратов могут служить «ЛАХТА-МИЛОН» , обеспечивающая генерацию излучений с длинами волн 0,63-0,67 мкм (активирующего фотосенсибилизатор при ФДТ) и 0,81 мкм, используемого для объемного нагрева при лазерной интестициальной термотераии (ЛИТТ). Использование этого прибора позволяет осуществлять сочетание двух эффективных методов лечения онкологических заболеваний. Другой пример — двухволновой аппарат с длинами волн 0,97 мкм (оптимальное для хирургического воздействия) и 1,56 мкм хорошо обеспечивающий прогрев хрящевой ткани, необходимый для лазерной термопластики хрящей, при минимальном повреждении кровенаполненной слизистой.
3. Примеры наиболее эффективного использования современных лазерных аппаратов.
Рассмотрим примеры наиболее эффективного использования описанной аппаратуры (более полное представление о современном состоянии использования описываемых аппаратов можно составить по материалам конференций, например, [3] и [4]).
Так получилось, что наиболее быстро новые аппараты получили признание в оториноларингологии (см. напр. [5]). Причем наряду с хирургическим воздействием, лазерные аппараты оказались весьма эффективными для такого вида силовой лазерной терапии, как лазерная термопластика хрящей [6]. В основе этой методики лежит способность хрящевой ткани обратимо менять свою упругость при нагреве до температуры около 70 ° С. Этот метод может быть использован для коррекции формы носовой перегородки, крыльев носа и ушных раковин. При осуществлении процедуры с помощью лазерного излучения через слизистую осуществляют нагрев хряща перегородки с фиксацией желаемой формы до остывания после прекращения действия лазерного излучения. При этом хрящ перегородки восстанавливает свою упругость, и перегородка принимает новую форму.
На рис.4 приведены фотографии носового хода до и после лазерной коррекции формы носовой перегородки, выполненной в ЛОР-клинике ММА им. Сеченова (Ю.М.Овчинников с сотр.). Процедура практически безболезненна, может проводиться в амбулаторных условиях и заменяет традиционную малоприятную и болезненную операцию, требующую последующей госпитализации. Более того, щадящее воздействие позволяет сохранить центры роста в хряще, что позволяет выполнять указанную процедуру детям.
Рис.4. Носовой ход до и после коррекции формы носовой перегородки методом лазерной термопластики хрящей.
С помощью полупроводниковых и волоконных лазерных аппаратов удалось реализовать [7] новый подход к лечению ЛОР патологий с использованием симультанных (лечение нескольких — обычно до 6 — патологий в ходе одного вмешательства) эндоскопических операций. Это стало возможным благодаря тому, что операции с применением лазерного излучения протекают бескровно, с малыми отеками. Малая болезненность лазерного воздействия позволяет использовать минимальную анестезию. Благодаря эндоскопической технике и точному дозированию лазерного излучения операции выполняются малоинвазивно и послеоперационные раны быстро заживают. Поскольку осуществляется одновременное лечение всех очагов инфекции в носоглотке, резко снижается вероятность рецидивов, а послеоперационное лечение осуществляется с минимумом лекарственных средств, как правило, без антибиотиков. Использование лазерной термопластики хрящей для коррекции формы носовой перегородки позволяет улучшить аэродинамику носа и вентиляцию пазух, что также способствует ускорению излечения.
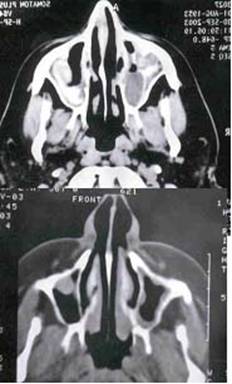
Пример результатов такого лечения, осуществленного С.А.Агеевой в дневном стационаре с последующим консервативным лечением в амбулаторных условиях, представлен в виде компьютерных томограмм на рис.5. На томограммах видна коррекция (в данном случае незначительная) формы носовой перегородки, очищение гайморовых и основных пазух, клеток решетчатого лабиринта. Видно соустье, наложенное на основную пазуху. При лечении использовался лазерный аппарат с длиной волны излучения 0,97 мкм . Необходимо отметить, что при хирургическом лечении пациентов без госпитализации особенное внимание должно быть уделено инструктажу пациентов относительно послеоперационного лечения, включая порядок действий в случае экстренных обстоятельств, например, при внезапно начавшемся кровотечении. Кроме этого опыт показывает, что результаты лечения бывают настолько разительны, что пациенты могут переоценить свое состояние, не довести амбулаторное лечение до конца и неосторожно обращаться со своим здоровьем, что особенно свойственно подросткам и молодым людям.
 |
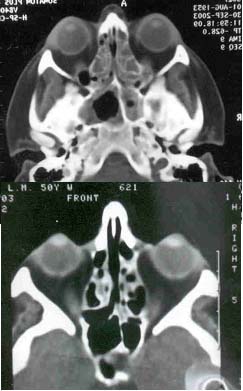 |
Рис.5. Компьютерные томограммы до (вверху) проведения оперативного лечения носоглотки с применением лазерного скальпеля, λ=0,97 мкм и через 2 месяца после лечения (внизу)
Не менее эффективно используется в ЛОР-практике излучение с длиной волны 1,56 мкм (см. напр. [6,8]). Благодаря большему (по сравнению с 0,97 мкм) поглощению в воде и меньшему в крови, при использовании этой длины волны для лазерной термопластики носовой перегородки удается уменьшить тепловое поражение слизистой. Наиболее универсальным для ЛОР применений оказался аппарат с двумя независимо регулируемыми рабочими излучениями 0,97 и 1,56 мкм, выводимыми в одно рабочее волокно.
Все шире используются в практике такие методы силовой лазерной терапии, как лазерная интерстициальная термотерапия (ЛИТТ) и фотодинамическая терапия (ФДТ) . ЛИТТ - метод подавления опухолей путем теплового воздействия на клетки, при котором цитотоксическое воздействие достигается за счет нагрева биоткани поглощаемым лазерным излучением. Классическая гипертермия злокачественных опухолей заключается в нагреве зоны опухоли до температуры 42,5-45°С, при которой раковые клетки погибают, а повреждение здоровых носит обратимый характер. При этом перегрев приводит к гибели здоровых тканей, а недогрев может привести к росту опухоли и метастазированию. Использование лазерного излучения упрощает достижение результата. Излучение вводится внутрь опухоли по световоду, оканчивающемуся специальным наконечником (диффузором), рассеивающим мощность в окружающие ткани. При этом условия, гибельные для раковых и переносимые для здоровых тканей, нужно создать на границах опухоли, тогда как вблизи диффузора ткань может перегреваться до температуры коагуляции. Благодаря этому возможно использовать ЛИТТ для лечения доброкачественных опухолей, например миом матки [9]. Поскольку требуется объемный нагрев биоткани, используется глубоко проникающее излучение ( длины волн 0,81 и 1,06 мкм ).
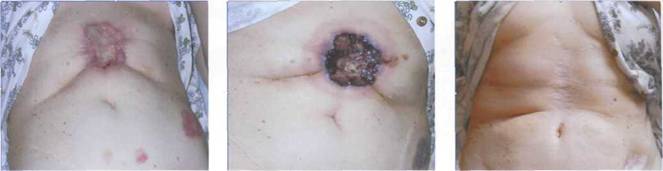
В ФДТ, первоначально разрабатывавшейся как метод лечения злокачественных опухолей, цитотоксическое действие осуществляется за счет воздействия синглетного кислорода, выделяемого при воздействии лазерного излучения на введенный в биоткань сенсибилизатор. Эта методика в настоящее время успешно используется не только для лечения доброкачественных и злокачественных опухолей, но также при лечении раневых процессов, и различных заболеваний (кожи, ЛОР - органов). Наиболее перспективными для использования в ФДТ представляется в настоящее время излучение с длиной волны 0.66-0.67 мкм в сочетании с новым фотосенсибилизаторами типа «Радахлорина» , [10] менее токсичными но сравнению с аналогичными препаратами предыдущих поколений, быстро накапливающимся в опухоли и быстро выходящем из организма. На рис.6 приведены результаты лечения методом ФДТ обширного первично-множественного базально-клеточного рака брюшной стенки, рецидивировавшего после хирургии, крио- и лучевой терапии. Лечение проводилось в Челябинской ГКБ №1 (В.А. Привалов, ЧГМА с сотр.). На самый большой очаг после ФДТ был наложен кожный лоскут. Исследования показали, что ФДТ оказывается эффективным методом лечения и различных воспалительных патологий. Она успешно используется, например, при лечениях гайморита. Метод лечение весьма распространенных воспалительных заболеваний полости рта с применением ФДТ получил название «бактериотоксическая терапия» [11].
Рис.6. Лечение обширного первично-множественного БКР брюшной стенки, рецидивировавшего после хирургии, крио- и лучевой терапии.
 |
1. — до ФДТ |
2.- на следующий день после ФДТ |
3.- через 2 года |
Практически при всех применениях лазеров в сочетании с современной эндоскопической техникой и пункционными методиками удается уменьшить травматичность операционного вмешательства, сократить сроки излечения, снизить вероятность послеоперационных осложнений. Немаловажно для удобства работы то, что аппараты хорошо встраиваются в стандартную эндоскопическую стойку, удобны при работе в рентген-операционных и c УЗИ контролем.
Лазерные скальпели с длиной волны 0,97 мкм хорошо зарекомендовали себя при малоинвазивных лапароскопических операциях [12] по удалению аппендикса, кист яичников у детей. На рис. 7 представлена фотография начала операции аппендицита, сделанная с экрана монитора эндоскопической стойки. Видно, насколько хорошо врач может наблюдать операционное поле.
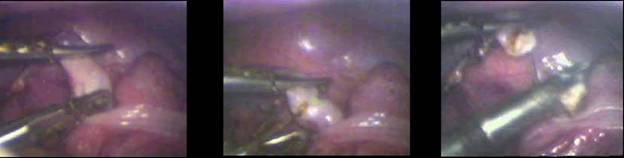
Рис.7 Лапароскопическая операция удаления аппендикса.
Общее число пациентов, прооперированных в Московской ДГКБ №20 им Тимирязева (Л.М.Рошаль с сотр.) превысило 500 чел. При этом были отмечены только два осложнения, выразившихся в интраоперационных кровотечениях, ликвидированных в ходе операций с помощью лазерного излучения.
Аппараты успешно используются и для лечения урологических заболеваний [13]. В частности лазерный аппарат с длиной волны 0,97 мкм и выходной мощностью до 30 Вт не только успешно использовался при операциях по поводу доброкачественной гиперплазии мочевого пузыря и коагуляции поверхностного рака мочевого пузыря, но и достаточно эффективно разрушал камни в мочевом пузыре при контактном воздействии. Традиционно для литотрипсии используются специально для этого предназначенные и дорогостоящие литотрипторы, на основе импульсных твердотельных лазеров с ламповой накачкой. Возможность проведения эффективных процедур без покупки дополнительного, к тому же крупногабаритного, оборудования представляется весьма привлекательной.
В условиях дневного стационара проводится лечение с применением описываемых аппаратов заболеваний межпозвонковых дисков. Для этих операций так же используется лазерное излучение с длинами волн 0,97 мкм [14] и 1,56 мкм [15].
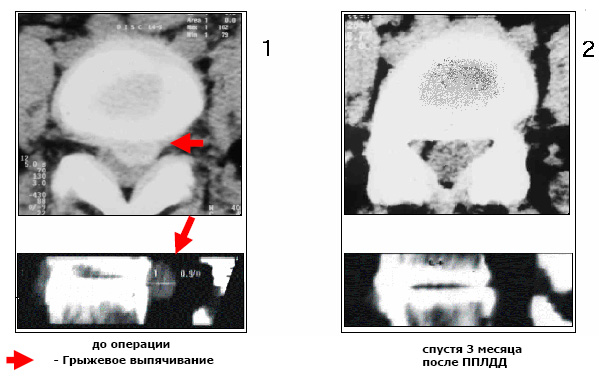
На рис.8 представлены для примера томограммы результатов лечения грыжи диска в сегменте L 4 - L 5 (грыжа указана стрелкой) у больной 43 лет методом пункционной поликанальной лазерной декомпрессии [14] с помощью лазерного излучения с длиной волны 0,97 мкм.
При этой методике под рентгеновским контролем диск пунктируется проводником диаметром 0,5 мм , после чего по проводнику вводится пункционная игла. Далее в иглу вводится световод и осуществляется воздействие лазерным излучением мощностью около 3 Вт в течение 1...1.5 мин. Особенностью указанного метода является формирование нескольких каналов в диске через один прокол за счет использования специально изогнутых игл. Малая травматичность метода обусловлена использованием тонкого световода, по которому подается излучение (диаметр по кварцу - 0,3мм).
При воздействии лазерного излучения на межпозвонковые диски отмечена стимуляция процесса регенерации хряща, которая улучшает результаты лечения.
Рис. 8 Результаты пункционного лечения грыжи межпозвонкового диска
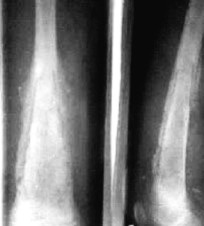
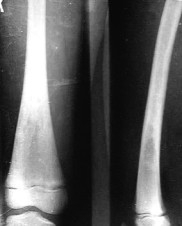
Высокая мощность излучения ( до 30 Вт ) с длиной волны 0,97 мкм на выходе тонкого рабочего световода (диаметр по кварцу 0,4мм) позволила создать высокоэффективные методики лечения лазерной остеоперфораций таких заболеваний, как остеомиелит [16]. По этой методике с помощью лазерного излучения передаваемого через кварцевый световод со специальным термостойким покрытием, в костной ткани через кожу и мышцы в зоне воспаления перфорируется несколько отверстий. Не вынимая световода, производится термотерапия костномозгового канала на пониженной мощности. Никаких дополнительных разрезов, дренирования мягких тканей и костно-мозгового канала не производится. При используемых режимах лазерного излучения не происходит глубоких термических поражений мягких тканей и костей. На рис. 9 представлены рентгенограммы до и после лечения подростка 14 лет с хроническим остеомиелитом бедра. Динамические бактериологические исследования показали быструю санацию гнойного очага и снижение числа высеваемых микроорганизмов ниже критического уровня. У всех больных в результате проведенного лечения отмечен быстрый и стойкий положительный эффект. При хроническом остеомиелите более чем в 90% случаев получена стойкая ремиссия, не отмечено ни рецидивов заболеваний, ни обострения процесса. Аналогичные результаты получены при использовании лазерной остеоперфорации при лечении костного и костно-суставного панариция и синдрома диабетической стопы.
Рис.9 Результаты лечение остеомиелита методом лазерной остеоперфораиции.
 |
|
 |
1 —до операции: |
|
2 — через 11 месяцев после операции. |
В настоящее время можно утверждать, что описываемые лазеры вошли в клиническую практику для лазерной реваскуляризации миокарда при лечении ишемической болезни сердца. До сих пор наиболее широко используются для этих целей лазеры на угле кислом газе. Вместе с тем их использование создает ряд проблем. Прежде всего, к ним в полной мере относятся упомянутые ранее недостатки, характерные для традиционных лазеров. Невозможность использования для транспортировки излучения оптического волокна приводит к необходимости работы в импульсном режиме. Импульсное воздействие на сердце в свою очередь требует его синхронизации с ритмами сердца, а это ведет к дополнительному усложнению аппаратуры. В то же время, для успешного осуществления реваскуляризации требуется достаточно быстрое (за время порядка 1 секунды) формирование в миокарде канала с минимальными термическими повреждениями его стенок. Это может быть выполнено при работе непрерывным или импульсно-периодическим излучением при контактной работе световодом. Подобные операции проводились с использование полупроводникового лазера с длиной волны 0,81 мкм . Но, как сказано выше, эта длина волны не является для такого воздействия оптимальной из-за плохого поглощения в биотканях. Использование для формирования каналов излучения полупроводникового лазера с длиной волны 0,97 мкм [17] позволяет сформировать канал с минимальным термическим поражением стенок, при зарастании которого, как и в случае использования углекислотных аппаратов, происходит процесс образования новых сосудов, прорастающих в окружающую мышечную ткань. На рис. 10 представлены фотографии гистограмм среза лазерного канала сразу после операции (рис. 10-а) и через месяц (рис. 10-6). На второй фотографии видно, что канал зарос соединительной тканью с проросшими сосудами. В докладе Л.А.Бокерии с сотр. на семинаре, прошедшем на выставке ЛИК-2005 (Москва), сообщено, что в НКЦ сердечно-сосудистой хирургии им. Бакулева с использованием полупроводникового лазера с длиной волны 0,97 мкм выполнено 54 операции. Отмечено, что такое излучение оказывается более эффективным по сравнению с 10,6 мкм в зонах миокарда с жировыми отложениями.
Рис.10. Результаты лазерной реваскуляризации миокарда при зарастании канала с неоваскулогенезом λ=0,97 мкм.
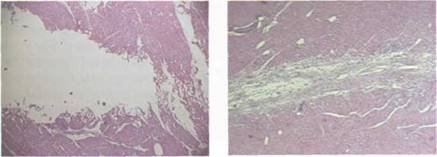 |
а- канал сразу после перфорации; |
|
б- канал через месяц после перфорации; |
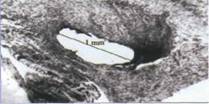
Рис.11. Результаты лазерной реваскуляризации миокарда при формировании сосуда λ=1,56 мкм.
Вместе с тем, по мнению многих врачей предпочтительнее было бы не зарастание лазерных каналов в миокарде, даже с неоваскулогенезом, а трансформация этих каналов в сосуды. Такой результат был получен [18] при использовании для реваскуляризации излучения волоконного лазера с длиной 1,56 мкм. В экспериментах на собаках гистограммы среза лазерного канала (рис. 11) через 34 суток показали сохранение просвета лазерных каналов и формирования стенок каналов по типу «толстостенных» сосудов с эндотелизацией. На февраль 2005г. в Новосибирском НИИ патологии кровообращения им Мешалкина пациентам выполнено 116 операций с использованием волоконного лазера на 1,56 мкм. Как правило, подобные операции сочетаются с аортокоронарным шунтированием.
Одной из первых областей медицины, где начали применяться лазеры, была офтальмология. Уникальной оказалась возможность воздействия лазерного излучения на биоткани через прозрачные среды глаза без их повреждения. Современные портативные аппараты прекрасно сопрягаются с щелевыми лампами и налобными офтальмоскопами, образуя удобные в эксплуатации лечебные комплексы. С их помощью осуществляется лечения заболеваний глаза методами транспупиллярной термотерапии (ТТТ), коагуляции сетчатки и переднего отрезка глаза, непрямой коагуляции сетчатки, эндо-лазерокоагуляции, транссклеральной циклофотокоагуляции и ретинопексии Успешно осуществляется лечение глаукомы методом лазерной перфорации. Широкое распространение получили лазерные методы коррекции глаза.
В последние годы во всем мире получили широкое распространение кератоабляционные операции по коррекции рефракционных дефектов зрения. Сутью различных разновидностей этого метода является изменение профиля роговицы путем удаления части ее с помощью ультрафиолетового излучения эксимерного лазера, за счет чего управляемо меняются оптические свойства роговицы, и происходит коррекция дефектов зрения. Вместе с тем, выяснилось наличие определенного фактора риска возникновения ряда послеоперационных осложнений, тем более неприятных, что воздействие на роговицу происходит непосредственно перед зрачком.
Более щадящим методом является рефракционная лазерная термокератопластика. В этом случае на роговицу глаза над радужной оболочкой или на склеру осуществляется нанесение точек лазерной коагуляции, создающих в роговице напряжения, меняющие ее кривизну над зрачком. Аппараты на основе волоконных лазеров позволяют обеспечить требуемый режим работы, причем подбором длины волны добиваются оптимальной глубины воздействия, при которой не происходит нежелательного воздействия на внутренние среды глаза и сетчатку. Кроме того, в дополнение к лазерным аппликациям, обеспечивающих требуемые напряжения возможно осуществление «уплощения» роговицы при ее мягком лазерном нагреве, подобное тому, как это делается при коррекции формы хрящей методом лазерной термопластики. Проведенные in vivo исследования на глазах кроликов [19] показали возможность уменьшения степени миопической рефракции глаза. Таким образом, обоснована более щадящая по сравнению с абляционной лазерной кератопластикой методика коррекции рефрактивных дефектов зрения.
Серьезные преимущества выявляются при использовании современных лазерных аппаратов при лечении последствий такой весьма распространенной болезни, как варикозная болезнь вен. Традиционно лечение осуществляется путем флебэктомии (удаления) расширенной большой подкожной вены (БПВ). Однако такая операция нередко сопровождается повреждением подкожных нервов и лимфатических коллекторов, длительным и болезненным для пациента послеоперационным лечением. Альтернативой являются методы химической и термической склеротератии, осуществляющие эндовазальную облитерацию БПВ. Из термических методов наиболее перспективным с точки зрения результатов лечения, ощущений пациента и переноса процесса в амбулаторные условия является эндовазальная лазерная коагуляция или EVLT ( EndoVenous Laser Treatment ) (см. напр. [20]). При этом методе в вену вводится рабочий световод, после чего включается лазерное излучение, и световод медленно вытягивается из вены с одновременной ее внутренней коагуляцией. В результате сразу после операции наблюдается спазм ствола БПВ и ее крупных притоков такой выраженности, что дифференцировать их от окружающих тканей не представлялось возможным. Отсутствие болевого синдрома, прекрасный косметический результат, а также быстрая социальная реабилитация являются несомненными достоинствами этой методики. Наиболее эффективным для осуществления EVLT на сегодняшний момент признано хорошо поглощаемое в крови излучение с длиной волны в области 0,94...0,98 мкм.
4. Заключение.
Таким образом, можно утверждать, что появление полупроводниковых лазеров и лазеров с полупроводниковой накачкой, привело к качественному улучшению характеристик лазерных аппаратов для хирургии и силовой терапии, расширению возможностей их использования. Эти аппараты работают в различных областях видимого и ближнего ИК диапазона, что позволяет оптимизировать характер воздействия на биоткани при минимизации нежелательного воздействия на окружающие органы. Они портативны, надежны, недороги и просты в эксплуатации, не требуют постоянного инженерно-технического обеспечения. Все это создало условия для внедрения лазерной техники для хирургии и силовой терапии в массовое здравоохранение. Внедрение в медицинскую практику методик, основанных на использовании подобных аппаратов, позволяет перенести в поликлинику или дневной стационар лечение многих заболеваний, которое при традиционных способах требует госпитализации. При этом повышение качества лечения, снижение вероятности рецидивов и осложнений сочетается с уменьшением болевых ощущений пациента. Таким образом, достигается высокий социальный и экономический эффект, может быть повышена эффективность использования средств, выделяемых на финансирование здравоохранения
Автор благодарит коллег, предоставивших свои иллюстративные материалы.
Литература
[1] Гельфонд М.Л. и др. Применение полупроводниковых лазеров в дерматологии и косметологии. //Пособие для врачей — Санкт-Петербург: Издательство СПб ГМУ им. Акад. Павлова.- 2001, 2004.
[2] Минкевич К.В., Процент Н.Е. Применение диодного лазера в гинекологии. // Практическое руководство. Санкт-Петербург: Издательство С-Пб ГМУ им. Акад. Павлова.- 2001.
[3] Мат. межд. научн.-практ. конф. «Лазерные технологии в медицинской науке и практическом здравоохранении» Лазерная медицина, 8(3) (2004).
[4] Мат. всеросс. научн. конф. «Полупроводниковые и волоконные лазеры в медицине» Ученые записки — С-Пб ГМУ им. Акад. Павлова -2004— т.Х1 — М4
[5] Гаращенко Т.И. с соавт. Лечение ЛОР-заболеваний с использованием лазерных скальпелей. //Пособие для врачей — Тверь: ООО «Губернская медицина» — 2000.
[6] В.Н.Баграташвили и др. «Лазерная термопластика хрящевых тканей» //В сб. «Использование лазеров для диагностики и лечения заболеваний» — М.: Лазерная ассоциация 200 l - e .3- C . U 4.
[7] Агеева С.А., Минаев В.П. Современные лазерные скальпели как основа внедрения высокоэффективных и стационарозамещающих технологий в оториноларингологии. // «Национальный медицинский каталог»—М.: Издательская группа «БДЦ-пресс» — 2003. — в. 1(2) — С.62.
[8] Мошняга В. Б. и др. Использование лазера на эрбийактивированном волокне для хирургического лечения больных экссудативным средним отитом. //Мат. всеросс. научи, конф. «Полупроводниковые и волоконные лазеры в медицине» Ученые записки — С.-Пб ГМУ и.м. Акад. Павлова -2004 — т . Х 1 — №4 — С .24-25.
[9] Roxana Chapmen. I/ Proceedings of Int. Workshop "Semiconductor and solid state Lasers in Medicine ", St.Peterbur , Russia , Изд . С .- Пб ГМУ им . Акад . Павлова. — 1997— Р. 26-31.
[10] Решетников А. В., Залевский А Д. Новый сенсибилизатор для клинического применения — «Радахлорин». Сборник трудов XVI международной конференции «Лазеры в науке, технике, медицине», 16-20 сентября 2005г., Адлер.- НТО РЭС им Попова, Москва, с. 92-94.
[11] О. Н. Рисованная Бактериоток-сическая терапия при лечении воспалительных заболеваний тканей парадонта. Лазерная медицина 10, в.2, с. 21-28(2006).
[12] Рошаль Л.М. и др. Использование полупроводникового лазерного скальпеля в детской лапароскопической хирургии. // «Национальный медицинский каталог» — М: Издательская группа «БДЦ-пресс» -2003 —в.2 —С.207-209.
[13] Аль-Шукри С.Х. и др.. Применение лазерной полупроводниковой хирургической установки в урологической практике. // Мат. всеросс. научн. конф. «Полупроводниковые и волоконные лазеры в медицине» Ученые записки — С.-Пб ГМУ им. Акад. Павлова -2004. — т.Х1—№4 —С. 18-19.
[14] Сандлер Б.И с соавт. Перспективы лечения дискогенпых компрессионных форм пояснично-крес-тцовых радикулитов с помощью пункционных неэндоскопических лазерных операций. // Владивосток: Далънаука, 2004. 181 с .
[15] Sobol E.N.et ai, Laser-Induced Growth of Cartilage and Bony Tissues on the Rabbit Intervertebral Discs. // Proceedings 12th Word Congress of Neurosurgery- Sydney , Australia- September 16-20, 2001, P 140. [16] Крочек И. В. и др. Лазерная остеоперфорация в лечении острого и хронического остеомиелита. II Методические рекомендации — Челябинск: ЧГМУ— 2004.
[17] Шипулин В.М, Коровин Н.В., Пав-люкова Е.Н. и др., «Первый опыт клинического применения полупроводникового лазера с длиной волны излучения 0,97мкм для непрямой ре-васкуляризациимиокарда». Лазерная медицина, т.9., в.З, 2005, с.55-56.
[18] Ларионов П. М. с соавт. «Различные варианты непрямой реваскуля-ризация миокарда с использованием лааутологичных стволовых клеток (экспериментальное исследование)» //Медицинская консультация -2004—N4(45) — С.2-7.
[19] Большунов А.В. с соавт.. Лазерная медицина, 8, в.4, 32-35. (2004)
[20] Богачев В.Ю. с соавт. Эндовазальная лазерная облитерация большой подкожной вены при варикозной болезни //«Ангиология и сосудистая хирургия» -2004 —№ 1-С.93-100
Источник: Медицинский алфавит. Больница. № 7(63) 2006, № 11(68) 2006. В.П.Минаев Современные лазерные аппараты для хирургии и силовой терапии — основа высокоэффективных стационарозамещающих технологий.






